担当者 加藤 久和


大阪大学医学部医化学トップページ > タンパク質分解を標的とした薬剤スクリーニング
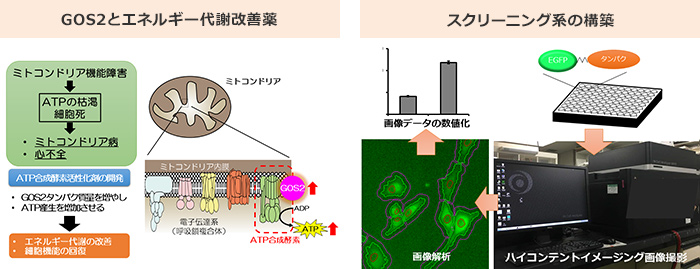
心臓は刻刻と変化する全身の循環血液需要に対応して即座に適応しなければならず、全身の臓器の中で最もエネルギー(ATP)を消費します。私たちは近年、ミトコンドリアにおけるエネルギー産生の調節分子として「Higd1a」「G0s2(ジーゼロエスツー)」と2つの分子を新たに同定しました[1, 2]。Higd1aはミトコンドリアの呼吸鎖複合体IV(チトクロームcオキシダーゼ)に結合して、エネルギー産生効率を上昇させます。一方、G0s2はATP合成酵素を介してエネルギー産生効率を上昇させることを見出しました。
G0s2の機能解析において、重要な技術としてin vitro, in vivoにおける心臓のミトコンドリアATP動態の可視化方法を確立しました。これまでは細胞破砕後しか測れなかった細胞内ATP量を、リアルタイムで測定できるようになりました。これはエネルギー需要が大きい心臓の分子病態を解明する上でとても重要な技術といえます。
このG0s2がミトコンドリア病や虚血性心不全など、ミトコンドリアの機能不全からエネルギー産生が障害される疾患の治療標的になると考え、G0s2のタンパク質分解メカニズムの解明を進めるとともに、このタンパク質分解を標的とした薬剤スクリーニング系を考案しました。私たちが考案した方法では、ハイコンテントイメージング装置という最新の細胞画像解析システムを用いて、タンパク質の”量的変化”と”形態変化”を同時にハイスループットに解析することができます。
またこのスクリーニング系は、様々な治療薬の開発に向けた薬剤スクリーニングに応用することができます。最近では消化器外科学教室との共同研究で、タンパク質分解を標的にした新たな抗がん剤の開発も進めています。
[1] Hayashi T, et al., Proc Natl Acad Sci U S A. 2015; 112(5):1553-8.
[2] Kioka H*, Kato H*, et al., Proc Natl Acad Sci U S A. 2014;111(1):273-8.
担当者 加藤 久和